新型冠状病毒的爆发引起了人们对冠状病毒的重视,并加速了在冠状病毒感染和宿主相应免疫机制领域的探索。在已知的可以感染人的7种冠状病毒中,SARS-CoV、MERS-CoV和SARS-CoV-2可以引起严重呼吸系统综合征,重症者可最终导致死亡。在病毒和宿主的互作和拮抗中,蛋白质翻译后修饰调控发挥重要作用。其中泛素化修饰作为调控蛋白质降解和功能的重要机制,在病毒和宿主的拮抗中重要性越来越受到关注。
近日,中南大学生命科学学院夏赞贤团队在国际权威学术期刊《信号转导与靶向治疗》(Signal Transduction and Targeted Therapy,简称STTT,IF=40.8)发表题为“A Cullin 5-based complex serves as an essential modulator of ORF9b stability in SARS-CoV-2 replication”的研究论文。该研究从病毒蛋白泛素化修饰的角度出发,筛选宿主靶向降解SARS-CoV-2附属蛋白的关键E3连接酶,发现了宿主的CUL5-TOM70-HSP90a蛋白质复合体是调控SARS-CoV-2附属蛋白ORF9b降解的关键因子,在病毒复制中发挥重要调节作用;并进一步证明了HSP90抑制剂具有靶向抗新冠药物的潜力。

在CUL5-TOM70-HSP90a蛋白质复合体中,TOM70发挥底物受体的作用,它将底物蛋白ORF9b与HSP90a和CUL5连接起来,形成一个复合物。CUL5触发ORF9b的泛素化和降解,而HSP90a则起到稳定ORF9b的作用(如图所示)。这一研究拓宽了我们对宿主CUL5的底物降解机制的认识,同时提供了一个很好的药物作用靶点—HSP90a,利用现有的HSP90抑制剂或研发特异地靶向HSP90a的小分子化合物,可开发新型抗新冠病毒药物。我们也在新冠病毒感染C57BL/6-hACE2小鼠模型中初步验证了这种策略的潜力。
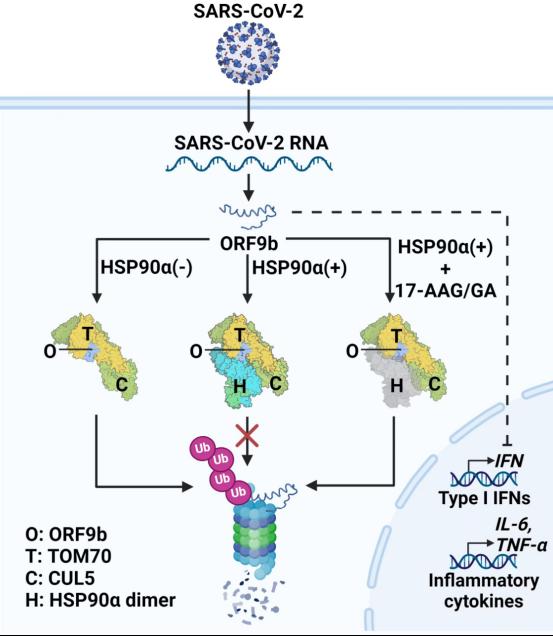
CUL5-HSP90a-TOM70复合物调控ORF9b的稳定性
该项研究得到国家重点研发计划(2021YFC2300103)、国家自然科学基金(U21A20384和82072293)和中国博士后基金(2023M731520)的资助。该项究也得到了广州国家实验室赵金存和蒋太交、清华大学程功、深圳市第三人民医院张政、中南大学代书炎等教授的大力支持。中南大学生命科学学院周宇筝博士(现为深圳市第三人民医院张政团队博士后)和博士研究生陈宗鹏为并列第一作者,中南大学生命科学学院夏赞贤教授是该论文的独立通讯作者。
原文链接:https://www.nature.com/articles/s41392-024-01874-5
初稿:陈宗鹏;初审:夏赞贤周宇筝;复审:胡艺俏;终审:陈超