肿瘤免疫治疗在临床上取得充分进展,但仍面临着免疫响应率低等挑战。抑制性的免疫微环境对免疫响应造成重要影响,如腺苷、TGF-β等免疫抑制因子抑制效应T细胞活性,肿瘤胞外基质屏障限制T细胞浸润,肿瘤微血管结构异常促进乏氧微环境等,调控肿瘤微环境是提高免疫响应的重要策略。
肿瘤治疗领域具有广泛的应用。中南大学生命科学学院赵岳涛课题组基于前期对纳米药物开展的研究成果,以光热效率高、生物可降解的纳米黑磷为载体,构建新型免疫纳米药物,对肿瘤胞外基质屏障、肿瘤微血管、免疫抑制因子等多种免疫抑制因素进行调控,有效降解肿瘤胞外基质屏障,重构肿瘤微血管结构,降低腺苷、TGF-β等抑制因子对免疫细胞的负面效应,多重协同效应共同提高免疫响应,促进肿瘤有效治疗,取得系列研究成果。
赵岳涛副教授与中南大学刘静教授、湘雅医院刘洪教授、陈翔教授合作,构建了一种可阻断腺苷和削弱肿瘤胞外基质屏障的新型免疫纳米药物。该纳米药物通过适体靶向富集至肿瘤部位,经近红外激光激发产生光热效应,有效降解肿瘤相关成纤维细胞和胶原蛋白所形成的致密基质屏障,促进T细胞的浸润。同时结合腺苷阻断对树突状细胞、调节性T细胞和效应T细胞的活性进行调节,协同增强免疫反应,有效抑制了黑素瘤的增长。研究成果以“Photothermal Nanobomb Blocking Metabolic Adenosine-A2AR Potentiates Infiltration and Activity of T cells for Robust Antitumor Immunotherapy”发表在期刊Chemical Engineering Journal (2022,IF: 16.744)。
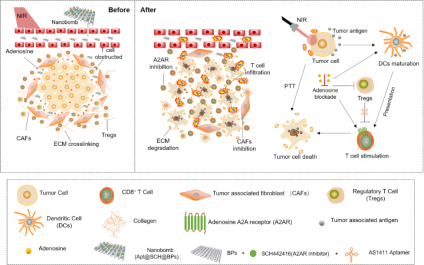
图1:免疫纳米药物协同光热效应与腺苷阻断调控肿瘤胞外基质、促进免疫响应的示意图
进一步地,赵岳涛副教授与中南大学张树冰教授、姜浩讲师合作,构建了一种可抑制TGF-β和调控肿瘤微血管的新型免疫纳米药物。该纳米药物利用光热效应协同TGF-β阻断共同促进树突状细胞的成熟、抑制调节性T细胞和激活效应T细胞。此外, TGF-β阻断能抑制肿瘤微血管生成,并调控微血管结构,缓解肿瘤乏氧微环境。该纳米药物协同血管正常化和光热效应共同促进免疫响应,有效抑制三阴性乳腺癌的生长。研究成果以“Immunostimulant Nanomodulator Boosts Antitumor Immune Response in Triple Negative Breast Cancer by Synergism of Vessel Normalization and Photothermal Therapy”发表Nano Research (2023, IF: 10.269)。

图2:免疫纳米药物协同光热效应与TGF-β调控肿瘤微血管、促进免疫响应的示意图
除此之外,赵岳涛副教授还针对化疗的药物耐受性问题,与中南大学刘静教授、萧小娟教授、湖南大学叶茂教授展开合作,以红细胞膜、BCMA抗体、黑磷量子点和硼替佐米构建了一种新型仿生光热纳米药物。在红细胞膜的伪装下,延长药物体内循环时间,并增强药物在肿瘤部位的富集。借助抗体靶向结合并抑制多发性骨髓瘤细胞表面的BCMA抗原,并结合黑磷量子点的光热效应与化疗药物协同激活细胞促凋亡信号,下调由于单药重复治疗带来的p65磷酸化反向增强的信号,有效克服硼替佐米的治疗耐受性。研究成果以“Anti-BCMA surface engineered biomimetic photothermal nanomissile enhances multiple myeloma cell apoptosis and overcomes the disturbance of NF-κB signaling in vivo”发表在期刊Biomaterials (2023, IF: 15.304)。
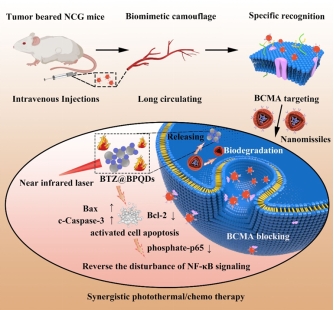
图3:仿生纳米药物协同光热效应克服化疗药物治疗耐受性的示意图
以上工作受到科技部国家重点研发计划、国家自然科学基金、湖南省优秀青年基金、湖南省自然科学基金、湖南省科技创新项目、中南大学创业基金等项目资助,相关研究成果正在申报国家发明专利。