2024年5月7日,Cell Death & Disease在线发表了中南大学生命科学学院罗
志勇教授研究团队发现并揭示ASS1抑癌新机制的最新成果。该研究论文题为“ASS1 inhibits triple-negative breast cancer by regulating PHGDH stability and de novo serine synthesis”(ASS1通过调节PHGDH的稳定性和丝氨酸的从头合成抑制三阴性乳腺癌的进展),该研究率先发现抑癌蛋白ASS1的首个直接互作蛋白磷酸甘油酸脱氢酶(PHGDH),该蛋白为丝氨酸从头合成途径的第一个催化反应且是唯一的限速酶,ASS1通过诱发PHGDH泛素化降解导致丝氨酸合成受阻,进而抑制三阴性乳腺癌的生长。


ASS1通过PHGDH泛素化降解抑制丝氨酸合成和TNBC进展的机制
乳腺癌是全球女性最常见的恶性肿瘤,是引起女性癌症死亡的重要病因。其中三阴性乳腺癌(Triple-negative breast cancer, TNBC)是乳腺癌的一种亚型,其特征是不表达雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER- 2)。其临床特征包括侵袭性强、易转移、高复发且预后较差。TNBC患者约占所有乳腺癌患者的15%,而且多见于年轻女性。为最难治疗的一种乳腺癌亚型,且目前缺乏有效的治疗方法。因此,迫切需要对该疾病的发生、发展机制开展深入的研究,探索新的治疗靶点及其靶向药物,以提高对该疾病的治愈率和生存期。
罗志勇教授团队前期研究并在Nature Communications杂志发表的原创成果—首次发现了多杀菌素A及其衍生物靶向激活抑癌蛋白—精氨酸代琥珀酸合成酶(ASS1)活性,通过降低天冬氨酸抑制嘧啶从头合成,进而抑制肿瘤的增殖与生长。进一步发现,添加嘧啶核苷酸可以部分挽救药物对乳腺癌细胞的抑制效应,提示ASS1可能存在新的抗肿瘤机制,其是否通过与特定的功能蛋白质互作调控信号转导或肿瘤代谢途径发挥抗肿瘤作用仍未有揭示和报道。罗志勇教授团队采用ASS1 Co-IP结合LC-MS/MS方法筛选出了ASS1互作蛋白—磷酸甘油酸脱氢酶(PHGDH),进一步的研究表明ASS1与PHGDH在TNBC细胞质中直接相互作用(图2)。TNBC细胞中ASS1显著负调控PHGDH蛋白表达,而PHGDH对ASS1蛋白表达无明显影响,临床病人TNBC组织中ASS1低表达与PHGDH高表达呈负相关,且与TNBC复发显著相关。ASS1主要通过泛素-蛋白酶体途径促进PHGDH降解,ASS1通过下调PHGDH蛋白表达,抑制TNBC细胞内丝氨酸和甘氨酸从头合成并抑制TNBC细胞增殖与肿瘤生长。该研究结果还表明,共同抑制细胞内丝氨酸和甘氨酸的合成且剥夺外源性丝氨酸和甘氨酸来源,可极大程度导致TNBC细胞增殖抑制。
中南大学罗志勇教授为该论文通讯作者,中南大学生命科学学院生物化学与分子生物学专业博士研究生罗文松和博士后邹自征为本文共同第一作者。

ASS1与PHGDH在TNBC细胞质中直接相互作用
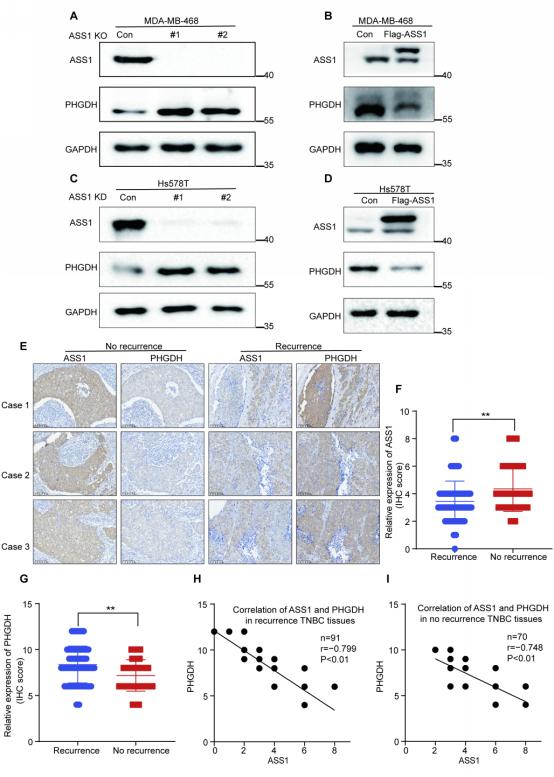
ASS1负调控PHGDH蛋白表达且ASS1低表达与PHGDH高表达与TNBC复发显著相关
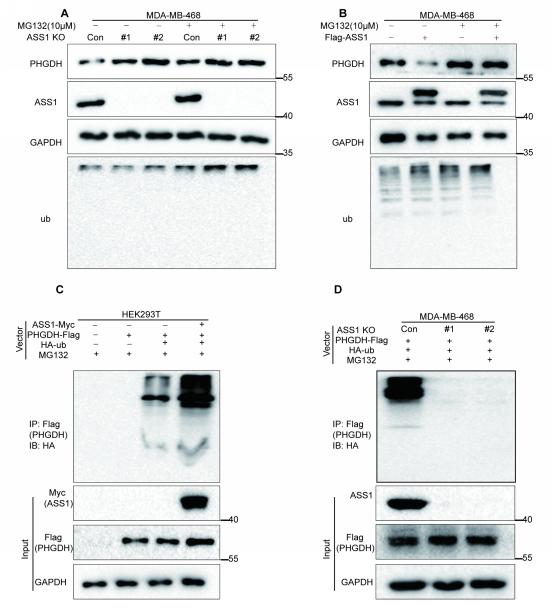
图4.ASS1促进PHGDH泛素化降解

图5ASS1通过下调PHGDH抑制丝氨酸合成和TNBC生长
该研究成果揭示了ASS1与PHGDH互作抑制丝氨酸从头合成的抗肿瘤新机制,并为PHGDH高表达肿瘤开展靶向丝氨酸代谢治疗提供了新的治疗途径和策略。原文链接为:https://www.nature.com/articles/s41419-024-06672-z。
初稿:罗文松,一审:罗志勇,二审:胡艺俏,三审:陈超