
在冠状病毒与宿主相互作用及拮抗的过程中,蛋白质翻译后修饰调控扮演了关键角色。近日,中南大学生命科学学院夏赞贤团队和深圳市第三人民医院(南方科技大学第二附属医院)/深圳国家感染性疾病临床医学研究中心张政团队合作在AdvancedScience(IF=14.3)发表题为“Lung-TargetedLipidNanoparticle-Delivered siUSP33Attenuates SARS-CoV-2Replication andVirulence byPromotingEnvelopeDegradation”的研究论文。本研究聚焦于新冠病毒蛋白的去泛素化修饰,发现泛素特异性蛋白酶33(ubiquitin-specific proteases 33, USP33)通过去泛素化修饰新冠病毒的E蛋白,增强了E蛋白的稳定性,进而促进了病毒的复制。基于此发现,本研究合成了装载siUSP33的肺部靶向脂质体纳米颗粒(lipid nanoparticle,LNP),并在该材料中创新性地添加了可电离的阳离子脂质,以提高其肺部靶向性。该研究使用了两种小鼠模型(过表达人源ACE2蛋白的小鼠感染模型以及K18-hACE2转基因小鼠模型),在活病毒感染条件下,证实了该策略在抗病毒和抗炎反应中的有效性,为治疗SARS-CoV-2提供了一种新的方法。未来的研究应专注于优化siUSP33的递送系统,以进一步提高肺部靶向性和治疗效果。进一步研究USP33在其他病毒感染复制中的作用,可能为开发广谱抗病毒药物提供新的策略。
。
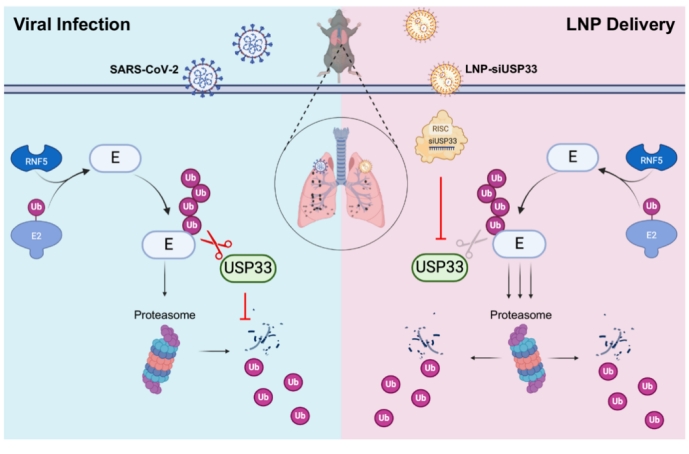
此项工作是我校夏赞贤教授团队继解析宿主的CUL5-TOM70-HSP90α蛋白质复合体调控SARS-CoV-2辅助蛋白ORF9b降解(STTT,2024)的研究后,有关病毒-宿主蛋白泛素化研究中的又一创新性成果,为研发抗新冠病毒药物提供了新的策略和方法。
深圳市第三人民医院(南方科技大学第二附属医院)/深圳国家感染性疾病临床医学研究中心张政教授、中南大学生命科学学院夏赞贤教授为本文共同通讯作者。深圳市第三人民医院博士后周宇筝、中南大学博士研究生廖雨洁和深圳市第三人民医院博士后樊路杰为并列第一作者。该项研究得到国家重点研发计划(2021YFC2300103)和国家自然科学基金(U21A20384、82072293)项目的资助。
作者:廖雨洁 初审:夏赞贤 复审:胡艺俏 终审:陈超