3月11日,中南大学陈翔教授、刘洪教授、刘静教授依托湘雅医院、生命科学学院、芙蓉实验室联合在Nature Genetics杂志发表了琥珀酰化修饰调控PD-L1稳定促进黑色素瘤抗肿瘤免疫(Alterations in PD-L1 succinylation shape anti-tumor immune responses in melanoma)的原创研究性论文。该研究首次揭示线粒体代谢酶CPT1A通过琥珀酰化修饰调控PD-L1蛋白降解的关键核心机制,提出了上调CPT1A联合免疫治疗抗黑色素瘤的全新治疗策略,为黑色素瘤免疫治疗提供精准靶标。

恶性黑色素瘤是一种以黑色素细胞异常增殖及代谢-免疫失稳态为重要特征的致死性皮肤疾病。尽管免疫检查点抑制剂PD-1/PD-L1单抗显著改善了部分黑色素瘤患者的生存,但其反应率仍不理想,且大约三分之一的初始应答者会复发。因此,解析耐药机制鉴定预测性生物标志物对于提高免疫检查点阻断疗法的疗效至关重要。研究团队通过多组学分析,揭示了琥珀酰辅酶A(succinyl-CoA)的核心调控作用。补充α-酮戊二酸(DMK)或琥珀酸(DES)代谢干预提升肿瘤细胞内琥珀酰辅酶A由CPT1A作为琥珀酰转移酶催化PD-L1第129位赖氨酸(K129)发生琥珀酰化修饰,激活PD-L1溶酶体途径降解,这一发现为破解免疫治疗耐药提供了全新视角。在临床前模型中,研究创新性地提出了CPT1A活化剂苯扎贝特(Bezafibrate)作为免疫治疗增敏剂,有望为晚期黑色素瘤患者带来更安全、可及的联合治疗方案。临床应用上,基于CPT1A与PD-L1的蛋白表达构建的疗效预测模型也展现出了较高的效能,为患者精准分层提供了重要理论依据。这一成果的临床转化潜力,标志着基础研究与实际医疗需求的高度融合。
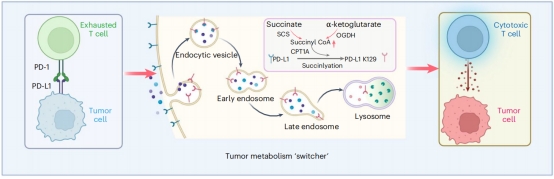
核心机制图
本研究首次揭示了琥珀酰化修饰是PD-L1降解的重要“分子开关”,其调控酶CPT1A兼具代谢与免疫双重调控功能,作为潜在的治疗靶点和生物标志物,为黑色素瘤的免疫治疗提供了新的策略。这一发现不局限于黑色素瘤,还可能为肺癌、结直肠癌等依赖代谢重编程的实体瘤提供普适性治疗策略;对公众健康具有深远影响,苯扎贝特作为已上市的安全药物,联合疗法有望大幅减少新药研发投入,让更多患者受益。
撰稿:梁龙
初审:刘静
复审:胡艺俏
终审:陈超